Al sur de la Península, tenemos un pequeño dragón, un dragón andaluz, que no echa fuego por la boca, pero que al igual que los dragones parece ser un superviviente mítico y mágico que pasa desapercibido para la mayoría de las personas. Vamos a conocerlo un poco mejor. ¿Te apuntas?


Descripción
El Camaleón común (Chamaeleo chamaeleon), puede alcanzar una longitud normalmente de entre 19-25 cm, aunque hay constancia de ejemplares hasta 30cm (J. Pablo de la Vega). Poseen una cabeza bien desarrollada a modo de casco. Con unos ojos cónicos que pueden girar 180o con un movimiento totalmente independiente, pudiendo mirar con un ojo a una posible presa y con el otro a un posible peligro. Su cuerpo es comprimido lateralmente.


Y su cola es prensil como la de los monos que usa ágilmente en sus desplazamientos y como cinturón de seguridad para no caer al suelo. Aunque para no caerse al suelo, dispone también de cinco dedos con grandes uñas, enfrentados a modo de pinzas, en grupos opuestos de 3 en un extremo y otros 2 en el otro. La lengua del dragón andaluz, o camaleón, es su verdadera herramienta para cazar y es que su longitud extendida puede llegar a ser la del tamaño corporal del propio individuo.


Distribución en la Península Ibérica
En la Península Ibérica se presenta principalmente en el Algarve portugués y en Andalucía en un área que ocupa los 444km2 entre las provincias de Huelva, Cádiz, Málaga, Granada y Almería (España) y Faro (Portugal) (Cuadrado, 2002; Salvador, 1998; Miraldo et al., 2005, Salvador, 2014).

Alimentación
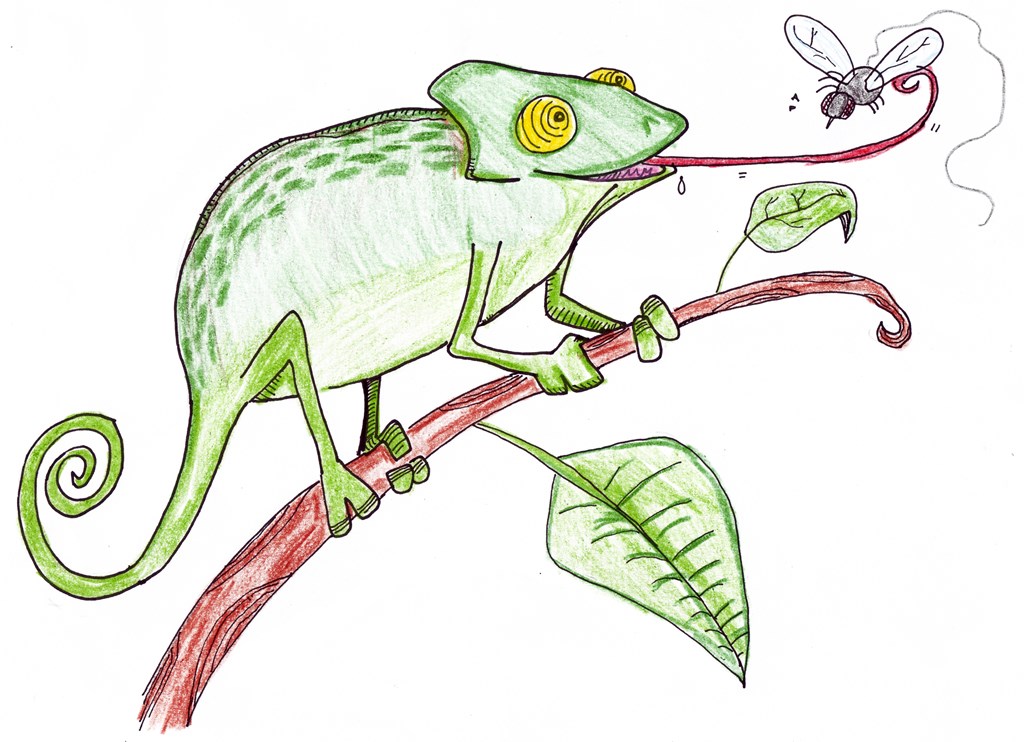
Consigue el alimento mediante una estrategia denominada, estrategia de espera o estrategia de “sentar y esperar”. Este tipo de caza al acecho reduce considerablemente el gasto energético empleado en la alimentación.
Es un reptil eminentemente insectívoro, muy poco especializado en un tipo determinado de presas y con una amplia variedad de presas adaptándose a las variaciones estacionales de los distintos grupos de insectos: mantis religiosa, mariposas (tanto diurnas como nocturnas), escarabajos, avispas, abejas, moscas, chinches.

Dimorfismo sexual
Las hembras presentan tallas mayores que los machos, así como una longitud mayor de la cola. Los machos presentan un engrosamiento en la base de la cola, justo en el sitio donde se alojan los hemipenes. En ocasiones el casco (cresta parietal) de los machos es algo más prominentes.
No sólo cambian de color para camuflarse, que también, sino que se ha estudiado que su librea puede variar para identificar el estado de salud del individuo, el del ciclo reproductivo, grado de irritabilidad y estrés, así como para exhibición, cortejo o termorregulación.
Cada sexo presenta libreas más o menos complejas y bien diferenciadas para ambos sexos. Los patrones de diseño y coloración están definidos para denotar distintas coloraciones según los estímulos entre ellos y el medio en el que habitan. No sólo cambian de color para camuflarse, que también, sino que se ha estudiado que su librea puede variar para identificar el estado de salud del individuo, el del ciclo reproductivo, grado de irritabilidad y estrés, así como para exhibición, cortejo o termorregulación.








Adaptación de las libreas de Blasco, M. 1985
- Libreas Básicas o fundamentales: Los machos poseen tonalidades pardas y/o grisáceas y las hembras con un fondo más verdoso. En ambos sexos, destacan líneas oscuras cefálicas, manchas dorsales y bandas anulares en la cola con manchas blancas en los flancos.


- Libreas reproductoras: Los machos cambian de color en presencia de hembras o de un macho competidor. Adquieren libreas amarillo intenso. Las hembras para mostrar su receptividad, exhiben libreas uniformes de tonos verdes (a menudo muy llamativos). Una vez fecundadas muestran su rechazo a los machos con libreas con manchas amarillentas o anaranjadas y al cabo de unos días con fondo azulado o negros, con manchas blancas y amarillas muy contrastantes.


Biología
Especie colonizadora posee una fortísima tasa de crecimiento que le permite alcanzar la madurez sexual antes del primer año de vida. Las hembras suelen copular con varios machos, lo que provoca un efecto de multipaternidad en su única puesta anual. A los 40 días (Entre Septiembre y finales de Octubre) depositan sus huevos (de 4-40) en una galería que cavan dependiendo de la humedad del terreno de hasta 25cm de profundidad. El peso de la puesta supera ampliamente el 50% del de la madre. El enorme gasto energético invertido en la reproducción determina una tasa de mortalidad altísima que hace que más del 75% de los reproductores desaparezca tras la puesta.
El periodo reproductor va desde finales de Junio hasta Septiembre. Los machos incrementan su actividad, frecuentando los lugares donde resultan más visibles, pero también más vulnerables para los predadores. Las hembras no muestran cambios sensibles de comportamiento.


Al cabo de varias cópulas la hembra cambia de coloración pasando de libreas básicas verdes a libreas de gravidez, rechazando con bravura a cualquier macho que se le acerque.


Hábitat
Es una especie arborícola ligada a la costa donde las arenas y suelos están sueltos para poder criar. En zonas de Cádiz y Málaga se puede encontrar incluso en huertos familiares y frutales, o jardines de muchas viviendas de segunda residencia. Síntoma de la pérdida de hábitat. La vegetación potencial propia es la de Pino piñonero (Pinus pinea), Enebro marítimo (Juniperus oxycedrus subsp. macrocarpa), Sabina marítima (Juniperus phoenicea subsp. turbinata), Escoba (Cytisus grandiflorus subsp. cabezudoi), Retama Blanca (Retama monosperma), Romero (Rosmarinus officinalis), Regaliz (Helychrisum picardii), Espino negro (Rhamnus lycioides subsp. oleoides).


Fábulas
Por último quería reseñar una fábula que todos/as de pequeño hemos escuchado sobre los camaleones y es que cuando colocas un camaleón sobre algo rojo explota. Eso es una verdadera tontería como tantas otras cosas vinculadas al mundo natural sin fundamento alguno.
Los camaleones no explotan sobre el color rojo


Bibliografía
- Barbadillo, L.J. (1996). “La Vida Secreta del Camaleón”. Biológica 3:38-53.
- Barbadillo, L. J. (1999). “Anfibios y Reptiles de la Península Ibérica, Baleares y Canarias”. Editorial GeoPlaneta. Barcelona.
- Blasco, M. (1985). “El Camaleón común Chamaeleo chamaeleon en la Península Ibérica”. Madrid
- Cuadrado, M. Y M. Rodríguez de los Santos (1990). “El Camaleón común en Andalucía. Distribución y conservación. AMA. Junta de Andalucía. Sevilla.
- Cuadrado, M. (1998). “Cortejo y reproducción del Camaleón común”. Quercus 152:24-28.
- Cuadrado, M. (2003). “Camaleón común”. En enciclopedia virtual de los Vertebrados Españoles. Carrascal, L.M.; Salvador (Eds.). Museo Nacional de Ciencias Naturales. Madrid
- López Fernández, L. R. (1998). “Estudio del Medio Natural y propuestas dirigidas a la mejora del hábitat del Camaleón común en el parque litoral de Isla Antilla”. Trabajo de prácticas. Escuela Politécnica Superior de la Universidad de Huelva.
- Mellado, J.; Giménez, L.; Gómez, J.J. y Sanjuán, M. (2001). “ El camaleón en Andalucía”. Distribución actual y amenazas para su supervivencia. Fundación Alcalde Zoilo Ruíz-Mateos. Rota, Cádiz.
- (1996). “Conservación del Camaleón común en la Península Ibérica”. Documentos Técnicos de Conservación de la Sociedad para la Conservación de los Vertebrados, Nº º2. Majadahonda
